Treonin
I dagens artikel ska vi ta upp ämnet Treonin, ett ämne som har skapat stort intresse på senare tid. Treonin är ett ämne som påverkar människor i alla åldrar och bakgrunder, och dess implikationer är olika och betydelsefulla. I den här artikeln kommer vi att utforska de olika aspekterna av Treonin, från dess ursprung och historia till dess inverkan på dagens samhälle. Dessutom kommer vi att undersöka olika perspektiv och åsikter om Treonin, med målet att ge en balanserad och fullständig syn på ämnet. Läs vidare för att ta reda på allt du behöver veta om Treonin!
| Treonin | |
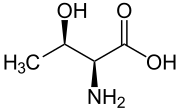  | |
| Systematiskt namn | Treonin |
|---|---|
| Övriga namn | 2-amin-3-hydroxybutansyra |
| Kemisk formel | C4H9NO3 |
| Molmassa | 119,120 g/mol |
| CAS-nummer | 72-19-5 |
| SMILES | C((C(=O)O)N)O |
| Egenskaper | |
| Löslighet (vatten) | 10,6 g/l (30 °C) |
| SI-enheter & STP används om ej annat angivits | |
Treonin (förkortas Thr eller T)[1] är en av de 20 aminosyror som utgör byggstenar i proteiner. Den innehåller en α-aminogrupp (som finns i den protonerade −NH+3 och bildas under biologiska förhållanden), en karboxylgrupp (som är i den deprotonerade −COO− formen under biologiska förhållanden), och en sidokedja som innehåller en hydroxylgrupp, vilket gör den till en hydrofil, polär, oladdad och essentiellaminosyra. Det är viktigt för människor, eftersom kroppen inte kan syntetisera det utan måste erhållas genom maten. Treonin syntetiseras från aspartat i bakterier som E. coli.[2] I den genetiska koden kodas treonin av fyra kodon: ACU, ACA, ACC och ACG.
Treoninsidokedjor är ofta vätebundna. De vanligaste små motiven som bildas är baserade på interaktioner med serin: ST-vändningar, ST-motiv (ofta i början av alfaspiraler) och ST-klammer (vanligtvis i mitten av alfaspiraler).
Modifieringar
Treoninresten är mottaglig för många posttranslationella modifieringar. Hydroxilsidokedjan kan genomgå O-länkad glykosylering. Dessutom genomgår treoninrester fosforylering genom verkan av ett treoninkinas. I sin fosforylerade form kan den identifieras som fosfotreonin. Fosfotreonin har tre potentiella koordinationsställen (karboxyl-, amin- och fosfatgrupp) och bestämning av koordinationssättet mellan fosforylerade ligander och metalljoner som förekommer i en organism är viktigt för att förklara fosfotreoninets funktion i biologiska processer.[3]
Historik
Treonin var den sista av de 20 vanliga proteinogena aminosyrorna som upptäcktes. Den upptäcktes 1936 av William Cumming Rose,[4] i samarbete med Curtis Meyer. Aminosyran fick namnet treonin eftersom den till sin struktur liknade treonsyra, en monosackarid med fyra kolatomer med molekylformel C4H8O5[5]
Stereoisomerer
  |
| L-treonin (2S,3R) och D-treonin (2R, 3S) |
  |
| L-allotreonin (2S,3S) och D-allotreonin (2R, 3R) |
Treonin är en av två proteinogena aminosyror med två stereogena centra, den andra är isoleucin. Treonin kan existera i fyra möjliga stereoisomerer med följande konfigurationer: (2S, 3R), ( 2R, 3S), (2S, 3S) och (2R, 3R). Emellertid används namnet L-treonin för en enda stereoisomer, (2S, 3R)-2-amino-3-hydroxibutansyra. Den andra stereoisomeren (2S, 3S), som sällan förekommer i naturen, kallas L-allotreonin.[6] De två stereoisomererna (2R, 3S)- och (2R, 3R)-2-amino-3-hydroxibutansyra är endast av mindre betydelse.
Biosyntes
Som en essentiell aminosyra syntetiseras inte treonin hos människor och måste finnas i proteiner i kosten. Vuxna människor kräver cirka 20 mg/kg kroppsvikt/dygn.[7] I växter och mikroorganismer syntetiseras treonin från asparaginsyra via α-aspartyl-semialdehyd och homoserin. Homoserin genomgår O-fosforylering. Denna fosfatester genomgår hydrolys samtidigt med omlokalisering av OH-gruppen.[8] Enzymer involverade i en typisk biosyntes av treonin är bland andra:
- aspartokinas
- β-aspartat semialdehyde dehydrogenase
- homoserin dehydrogenas
- homoserinkinas
- treoninsyntas.

Metabolism
Treonin metaboliseras på minst tre sätt:
- Hos många djur omvandlas det till pyruvat via treonindehydrogenas. En intermediär i denna väg kan genomgå tiolys med CoA för att producera acetyl-CoA och glycin.
- Hos människor är genen för treonindehydrogenas en inaktiv pseudogen,[9] så treonin omvandlas till α-ketobutyrat. Mekanismen för det första steget är analog med den som katalyseras av serindehydratas, och serin- och treonindehydratasreaktionerna katalyseras förmodligen av samma enzym.[10]
- I många organismer O-fosforyleras det av ett kinas som förbereder för ytterligare metabolism. Detta är särskilt viktigt hos bakterier som en del av biosyntesen av kobalamin (vitamin B12), eftersom produkten omvandlas till (R)-1-aminopropan-2-ol för inkorporering i vitaminets sidokedja.[11]
- Treonin används för att syntetisera glycin under den endogena produktionen av L-karnitin i hjärnan och levern hos råttor.[12][13]
Källor
Mat som har hög halt av treonin är keso, fågel, fisk, kött, linser, svarta sköldpaddsbönor[14] och sesamfrön.[15]
Racemisk treonin kan framställas från krotonsyra genom alfa-funktionalisering med användning av kvicksilver(II)acetat.[16]
Referenser
- Den här artikeln är helt eller delvis baserad på material från engelskspråkiga Wikipedia, Threonine, 14 januari 2022.
Noter
- ^ ”Nomenclature and Symbolism for Amino Acids and Peptides”. Nomenclature and Symbolism for Amino Acids and Peptides. IUPAC-IUB Joint Commission on Biochemical Nomenclature. 1983. http://www.chem.qmul.ac.uk/iupac/AminoAcid/AA1n2.html.
- ^ Raïs, Badr; Chassagnole, Christophe; Lettelier, Thierry; Fell, David; Mazat, Jean-Pierre (2001). ”Threonine synthesis from aspartate in Escherichia coli cell-free extracts: pathway dynamics”. Biochem J 356 (Pt 2): sid. 425–32. doi:. PMID 11368769.
- ^ Jastrzab, Renata (2013). "Studies of new phosphothreonine complexes formed in binary and ternary systems including biogenic amines and copper(II)". Journal of Coordination Chemistry. 66 (1): 98–113. doi:10.1080/00958972.2012.746678
- ^ A Dictionary of scientists.. Daintith, John., Gjertsen, Derek.. Oxford: Oxford University Press. 1999. Sid. 459. ISBN 9780192800862. OCLC 44963215. https://books.google.com/books?id=AtngooiwXikC&pg=PA459.
- ^ Meyer, Curtis (20 July 1936). ”The Spatial Configuation of Alpha-Amino-Beta-Hydroxy-n-Butyric Acid”. Journal of Biological Chemistry 115 (3): sid. 721–729. doi:. http://www.jbc.org/content/115/3/721.full.pdf.
- ^ ”Nomenclature and symbolism for amino acids and peptides (Recommendations 1983)”. Pure and Applied Chemistry 56 (5): sid. 601, 603, 608. 1 January 1984. doi:.
- ^ Institute of Medicine (2002). ”Protein and Amino Acids”. Dietary Reference Intakes for Energy, Carbohydrates, Fiber, Fat, Fatty Acids, Cholesterol, Protein, and Amino Acids. Washington, DC: The National Academies Press. Sid. 589–768. doi:. ISBN 978-0-309-08525-0.
- ^ Lehninger, Albert L.; Nelson, David L.; Cox, Michael M. (2000). Principles of Biochemistry (3rd ed.). New York: W. H. Freeman. ISBN 1-57259-153-6.
- ^ Stipanuk, Martha H.; Caudill, Marie A. (2013) (på engelska). Biochemical, Physiological, and Molecular Aspects of Human Nutrition – E-Book. Elsevier Health Sciences. ISBN 9780323266956. https://books.google.com/books?id=XVNPAQAAQBAJ&pg=PA310.
- ^ Bhardwaj, Uma; Bhardwaj, Ravindra (på engelska). Biochemistry for Nurses. Pearson Education India. ISBN 9788131795286. https://books.google.com/books?id=93yeKr9W9TwC&pg=PA129.
- ^ Fang, H; Kang, J; Zhang, D (30 January 2017). ”Microbial production of vitamin B12: a review and future perspectives.”. Microbial Cell Factories 16 (1): sid. 15. doi:. PMID 28137297.
- ^ Adeva-Andany, M; Souto-Adeva, G; Ameneiros-Rodríguez, E; Fernández-Fernández, C; Donapetry-García, C; Domínguez-Montero, A (January 2018). ”Insulin resistance and glycine metabolism in humans.”. Amino Acids 50 (1): sid. 11–27. doi:. PMID 29094215.
- ^ Dalangin, R; Kim, A; Campbell, RE (27 August 2020). ”The Role of Amino Acids in Neurotransmission and Fluorescent Tools for Their Detection.”. International Journal of Molecular Sciences 21 (17): sid. 6197. doi:. PMID 32867295.
- ^ ”Error”. ndb.nal.usda.gov. http://ndb.nal.usda.gov/ndb/foods/show/4632?fg=&man=&lfacet=&count=&max=&sort=&qlookup=&offset=&format=Full&new=. Arkiverad 16 november 2018 hämtat från the Wayback Machine. ”Arkiverade kopian”. Arkiverad från originalet den 16 november 2018. https://web.archive.org/web/20181116093022/http://ndb.nal.usda.gov/ndb/foods/show/4632?fg=&man=&lfacet=&count=&max=&sort=&qlookup=&offset=&format=Full&new=. Läst 7 april 2023.
- ^ ”SELF Nutrition Data - Food Facts, Information & Calorie Calculator”. nutritiondata.self.com. http://nutritiondata.self.com/.
- ^ Carter, Herbert E.; West, Harold D. (1940). "dl-Threonine". Organic Syntheses. 20: 101.; Collective Volume, vol. 3, p. 813.
Externa länkar
 Wikimedia Commons har media som rör Treonin.
Wikimedia Commons har media som rör Treonin.- Threonine biosynthesis
- CID 205
- CID 6288
| |||||||||||||||||||